来源:澎湃新闻
源自大羊驼(llama)的两种小而稳定的纳米抗体(nanobodies),被证明可以中和新冠病毒SARS-CoV-2,并且以一种与其他抗体不同的新方式与刺突蛋白(S蛋白)结合。该结论来自英国罗莎琳德·富兰克林研究所(Rosalind Franklin Institute)、牛津大学、DIAMOND光源有限公司等团队的一项最新研究。

当地时间7月13日,该研究发表于《自然-结构和分子生物学》(nature structural&molecular biology)。论文通讯作者为牛津大学领导纳米抗体项目的Raymond J. Owens教授,以及牛津大学结构生物学教授、罗莎琳德·富兰克林研究所主任James H. Naismith 教授。
Naismith教授说,“这些纳米抗体有可能以类似康复血清的方式被利用,有效地阻止患者体内病毒的发展。我们能够将其中一种纳米抗与人源抗体结合,并证明这种结合比单独使用两种抗体更有效。联合使用特别有用,因为病毒必须同时改变很多才能逃脱;病毒很难做到这一点。纳米抗体也有潜力成为一种强大的诊断工具。”
COVID-19目前尚没有特效治愈方法或疫苗。然而,临床已有案例证明,向危重病人输含有人体抗病毒抗体的恢复期患者血清可大大改善临床结果。这种方法即被称为被动免疫。
被动免疫这一传统的方法实际上已经使用了100多年。放在新冠病毒治疗之下,它需要给患者使用能中和病毒的制剂,可以利用SARS-CoV-2感染康复者的血清,也可以利用纯化抗体。目前已知的是,SARS-CoV-1的抗体能通过阻断该病毒刺突蛋白与ACE2相结合来中和病毒,但许多都不和SARS-CoV-2发生交叉反应。
另外还有一个关键的问题是,要确定具有正确抗体的合适供体,并安全提供这种血液产品并不容易。研究团队认为,一种可根据需要生产的实验室产品将具有相当大的优势,并可在该病早期使用,可能更有效。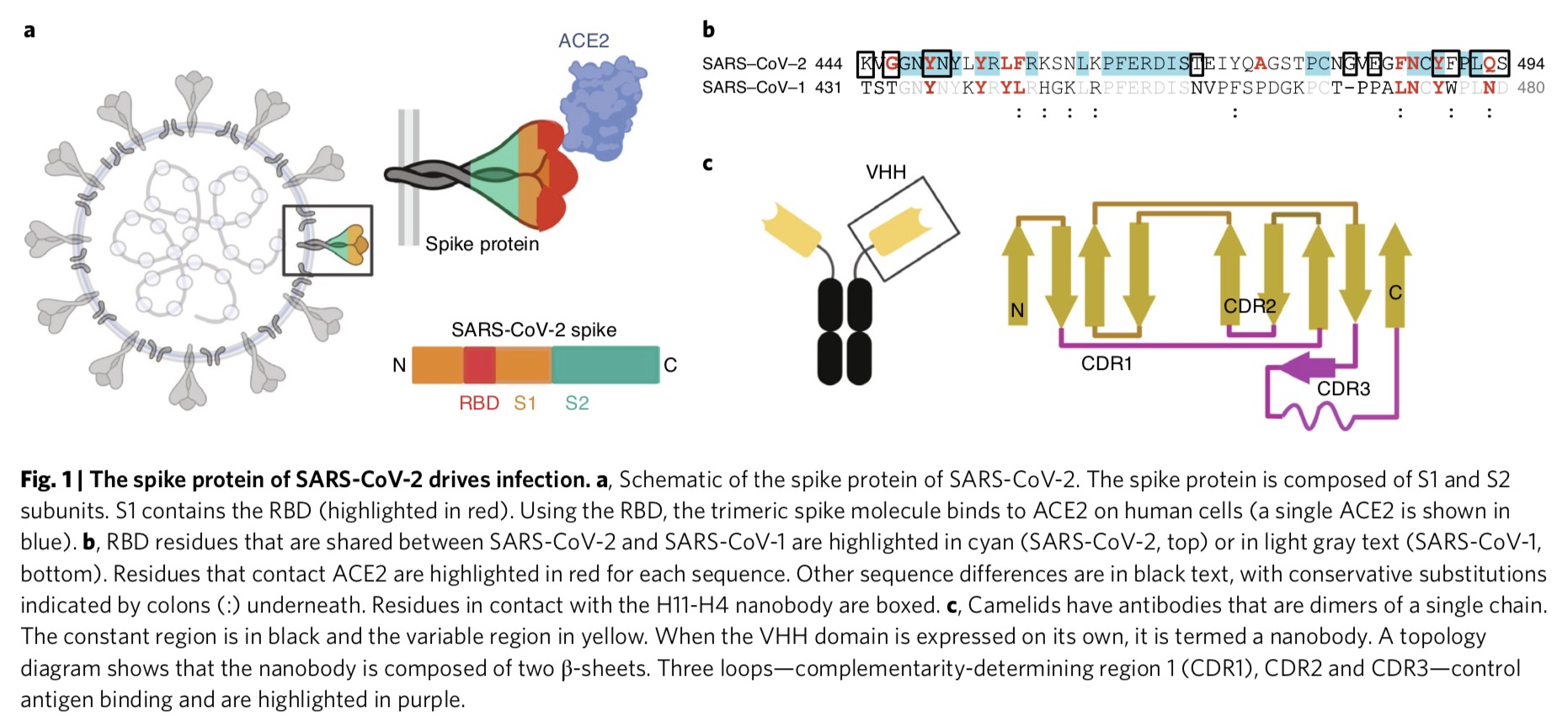

人源抗体和大部分哺乳动物的抗体一样,有重链和轻链两个链,而大羊驼一类的骆驼科动物,还有一种只有单个重链的抗体变体。这种单链抗体的抗原特异性可变部分称为VHH结构域,通常被称为纳米抗体。
研究指出,纳米抗体体积小且稳定,制备简单,因此常被用来替代诊断和成像用的传统抗体。目前正在开发能作为SARS-CoV-2研究工具和潜在治疗药物的纳米抗体。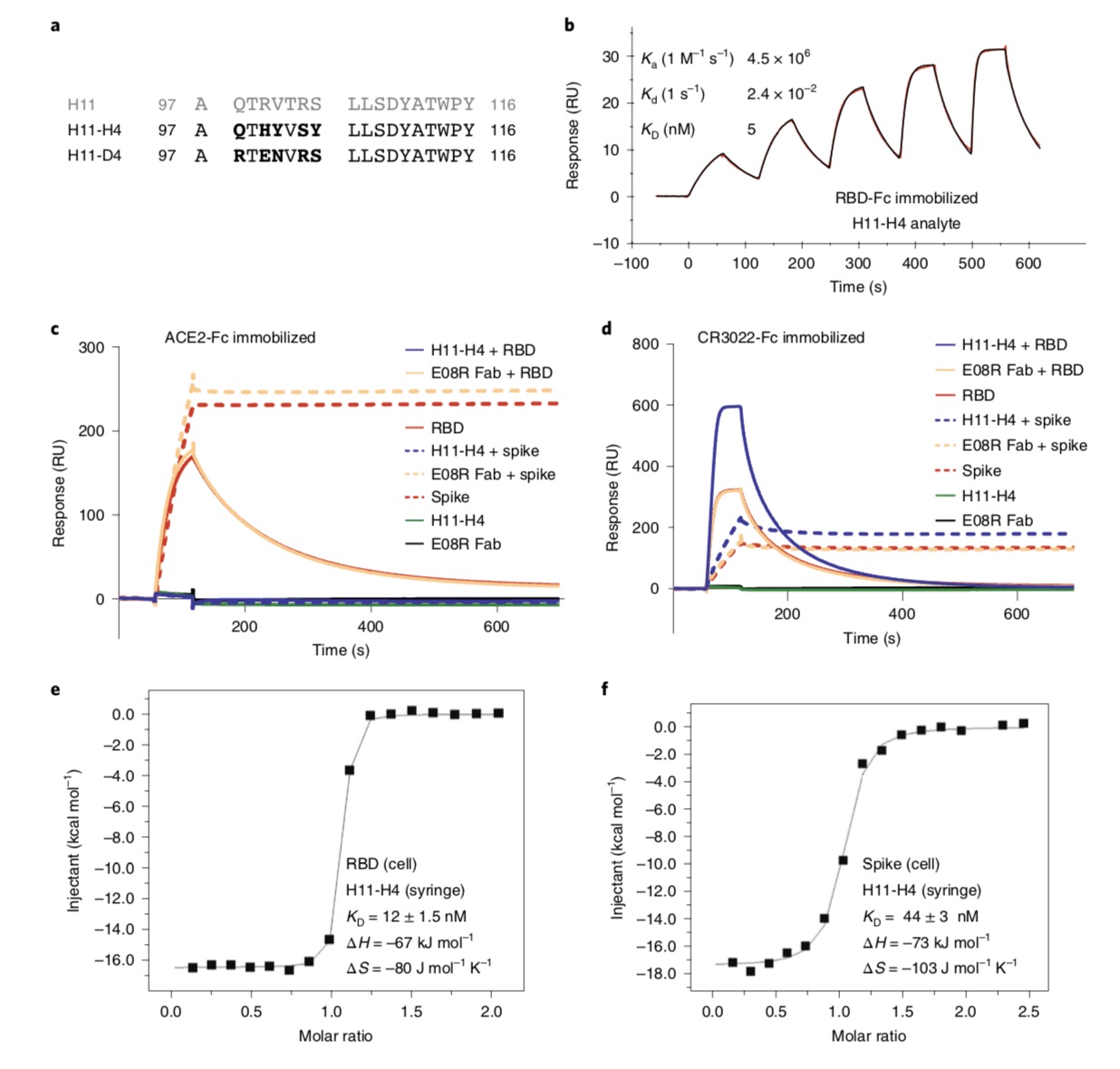

利用天然的大羊驼单域抗体库和基于PCR技术,研究团队制备了两个密切相关的纳米抗体,即H11-D4和H11-H4,它们能结合RBD(KD分别为39 nM和12nM),并阻断其与ACE2的相互作用。
单颗粒冷冻电镜成像显示,这两个纳米抗体都与S蛋白三聚体中的三个RBDs结合。每个纳米抗体-RBD复合物的晶体结构揭示了两个纳米体如何识别相同的表位,该表位ACE2结合区域紧密相邻且有少量重叠,解释了RBD-ACE2相互作用的阻断。
纳米抗体-Fc融合显示对SARS-CoV-2具有中和活性(对H11-H4为4-6nM,对H11-D4为18nM),与人源抗体CR302216联用还能增强中和能力。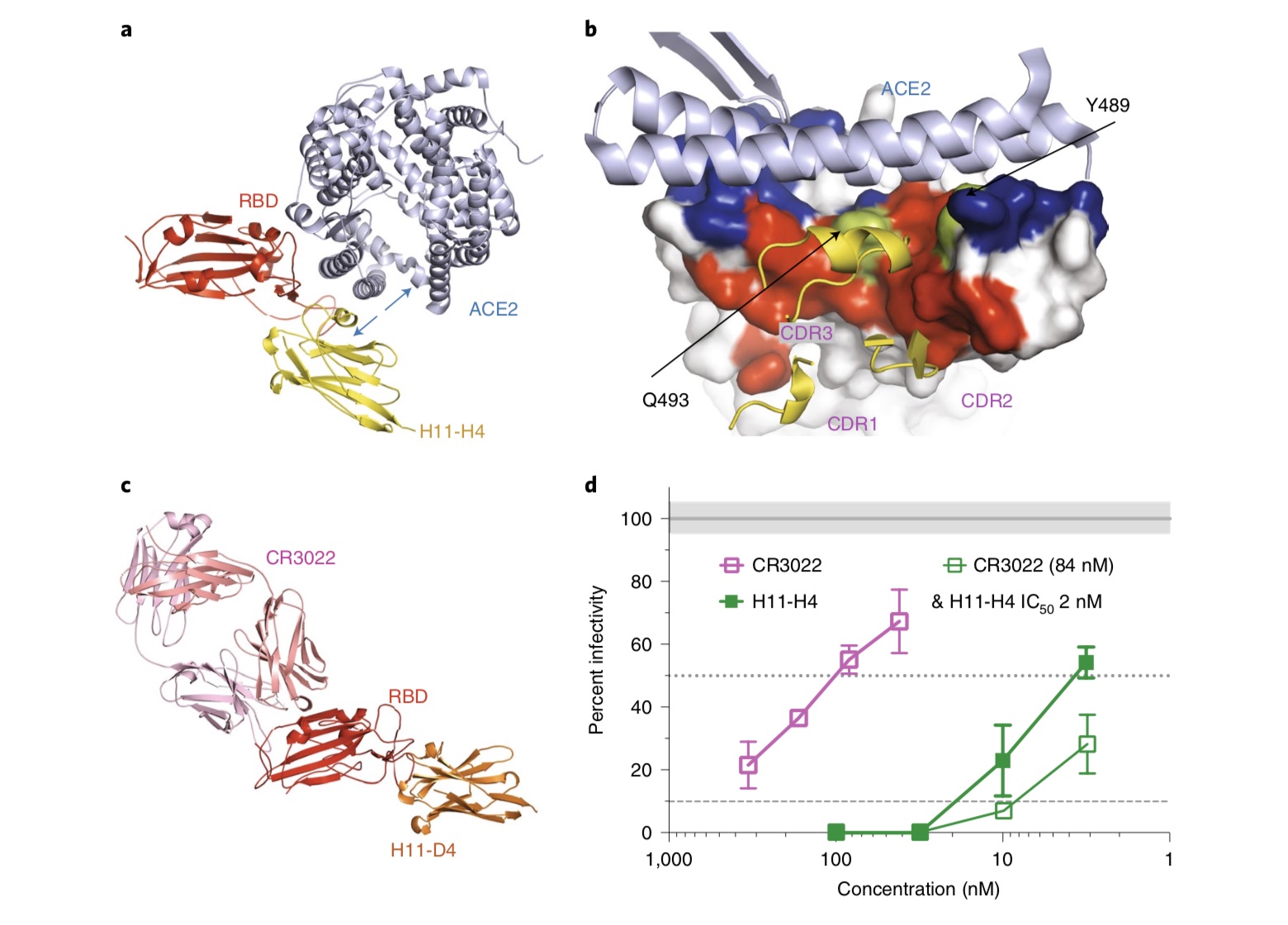

CR3022抗体来自于一名恢复期SARS-CoV-1患者,对SARS-CoV-1和SARS-CoV-2 RBD均有交叉反应。此前有两项研究报道了CR3022与SARS-CoV-2 RBD结合的晶体结构,并显示其靶表位距离ACE2结合区较远,这与CR3022不阻碍RBD与ACE2结合的观察结果一致。
另一项关于CR3022的研究则报道了高效的SARS-CoV-2中和活性,这似乎来自于S蛋白三聚体的不稳定性,这是中和SARS-CoV-2的新机制。研究团队指出,在流感和人体免疫缺陷病毒中,已观察到抗体对病毒蛋白的去稳定作用。
这项研究工作表明,纳米抗体成熟技术可以用于生产一种高中和剂,实时对抗一种新出现的病毒威胁。研究团队认为,H11-H4和H11-D4纳米抗体可应用于实验室合成的中和抗体“鸡尾酒”,用于重症COVID-19患者的被动免疫。
这项研究工作还在继续,Owens教授提到,“我们希望能将这项突破推进到临床前试验阶段。”
免责声明:本文转载自互联网,其内容言论不代表本站观点。如果其链接、内容的侵犯您或第三方权益,烦请提交相关信息发邮件至[email protected]我们将及时予以处理。
